|
|

|

 
INTRODUCTION
L'être humain est une entité infiniment complexe qui essaie de se situer entre l'infiniment grand et l'infiniment petit.
Les sciences du cosmos et la conquête de l'espace savent encore enthousiasmer l'homme qui regarde les étoiles. L'infiniment grand fascine par la beauté et la diversité des images récoltées par les astronomes: vastes galaxies spirales, nuages interstellaires multicolores, astronautes se promenant sur le sol lunaire, diversité stupéfiante des surfaces planétaires captées par les sondes spatiales...
Toutes ces merveilleuses photographies riches en détail stimulent notre imagination et nous rêvons de mondes extra-terrestres à explorer
L'autre infini, lui, est plus mystérieux et plus austère:
Les images de particules atomiques se réduisent à des points ou à des traces spiralées.
La science qui étudie cet infiniment petit se nomme la physique des particules. Ses instruments d'observation sont des microscopes électroniques et de gigantesques collisionneurs. Ces appareils n'offrent cependant pas au public d'images aussi spectaculaires que celles des télescopes astronomiques.
Et pourtant, nous sommes d'autant plus liés à cet univers des particules élémentaires que nous en sommes intimement constitués, ainsi que tout le reste de l'Univers.
Je vous invite donc à un fabuleux voyage vers les confins de la matière. Vous découvrirez un monde infraterrestre où notre sens commun est mis à mal et où la matière flirte avec le vide
HISTOIRE DE L'ATOME 
NAISSANCE DE L'ATOME 
ou
Y a-t-il un atome à Bohr?
LES QUATRE ELEMENTS D'EMPEDOCLE D'AGRIGENTE
De sa belle ville sicilienne d'Agrigente, le Grec Empédocle (vers 492-432 av. J.-C.) divisa la matière en quatre éléments, qu'il appela aussi "racines":
l'eau la terre l'air le feu
Ces éléments sont mus par les forces de l'amour et de la haine.
Dans l'amour absolu, ils forment une unité homogène, alors que la haine les sépare. Lorsque ces deux forces entrent en conflit, le mélange des éléments fait surgir les choses matérielles.
Cette vision de la matière préfigure déjà un peu la nôtre par la notion d'éléments liés par des forces attractives et répulsives.
LES GRECS ATOMISTES
Le mot "atome" vient du grec "a-tomos" et signifie "insécable". Cette notion fut inventé par Leucippe de Milet en 420 avant J.C.
Son disciple, Démocrite d'Abdère (vers 460-370 av. J.-C.), expliquait que la matière était constituée de corpuscules en perpétuel mouvement et dotés de qualités idéales; Ces corpuscules étaient:
invisibles à cause de leur extrême petitesse
insécables ou indivisibles comme leur nom l'indique
pleins (pas de vide à l'intérieur)
éternels car parfaits
entourés d'un espace vide (pour expliquer le mouvement et les changements de densité)
ayant une infinité de formes (pour expliquer la diversité observée dans la nature)
L'atome est-il d'origine grecque?
Il semble qu'à la même époque que celle de Leucippe, il existait en Inde une philosophie (système Vaiseshika) qui enseignait déjà que la matière était formée d'atomes indestructibles: Leur assemblage en choses visibles est dégradable et, au terme d'une période du monde, les liaisons atomiques se dissolvent, puis après une phase de repos, se réunissent en un nouveau monde...Donc pas de monopole atomiste grec...La doctrine atomiste greque sombra dans l'oubli pendant de longs siècles et laissa place au triomphe durable de la théorie des quatre éléments d'Empédocle
L'ALCHIMIE DU MOYEN-AGE
Née au Moyen-Age, l'alchimie est née des progrès de la métallurgie et de l'insuffisance de la théorie des 4 éléments à représenter la diversité de la matière.
Le grand dessein de l'alchimie était d'obtenir la transmutation des métaux "vils" (tels que le cuivre) en métaux "nobles" tels que l'or. Sans doute parce que le succès du "Grand Oeuvre" (la transmutation) ouvrait des perspectives de richesse et de pouvoir, l'activité des alchimistes s'entourait de secret et s'inscrivait dans une démarche très ancienne d'ésotérisme et d'occultisme.
La démarche de l'alchimie (comme celle de l'astrologie d'ailleurs) établissait des liens symboliques qui unissaient le microcosme au macrocosme (monde des planètes). Par exemple, l'élément Plomb était associé à la planète Saturne car celle-ci nous apparaît d'une couleur jaune "plombée".
Malgré leur croyance ésotérique, les alchimistes développèrent l'observation, l'expérimentation, la mesure et la classification des éléments: l'alchimie est donc un précurseur respectable de la chimie. D'ailleurs n'oublions pas que Newton en fut adepte et que la physique actuelle a réalisé le vieux rêve de la transmutation en transformant certains atomes en d'autres.
LE TABLEAU DE MENDELEIEV
En 1869, le chimiste russe Dimitri Mendeleïev construit un tableau qui classe tous les éléments chimiques alors connus d'après leurs propriétés chimiques. Ce tableau servira plus tard à classer méthodiquement tous les atomes naturels et artificiels d'après leur numéro atomique (c'est-à-dire le nombre de leurs protons).
 == == 
DECOUVERTE DE L'ELECTRON 
Et 1897, Thompson découvre le premier composant de l'atome: l'électron, particule de charge électrique négative.
En 1904, il propose un premier modèle d'atome, surnommé depuis "le pudding de Thompson".
Il imagine l'atome comme une sphère remplie d'une sustance électriquement positive et fourrée d'électrons négatifs "comme des raisins dans un cake".
decouverte du noyau
 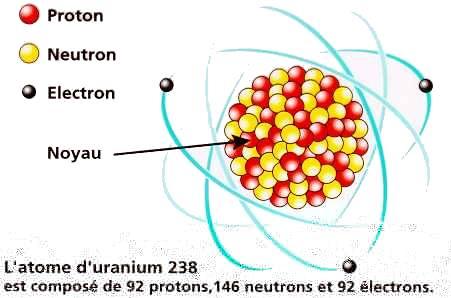
En 1912, Rutherford (physicien néo-zélandais) découvre le noyau atomique.
Son nouveau modèle d'atome montre que sa charge électrique positive et que l'essentiel de sa masse est concentré en un noyau quasi-ponctuel.
Les électrons de l'atome se déplacent autour de ce noyau tels des planètes autour du Soleil, et la force électrique attractive (la charge - de l'électron attirant la charge du noyau) joue le rôle de la force de gravitation pour les planètes; d'où le nom de modèle d'atome planétaire.
A noter que contrairement à l'atome des Grecs, celui de Rutherford n'est ni indivisible (puisque composite), ni plein puisqu'il contient essentiellement du vide: La distance noyau-électrons est 100.000 fois plus grande que le diamètre du noyau lui même (diamètre du noyau = 10-15 mètre = 1 Fermi).
 
DECOUVERTE DES NUCLEONS
Rutherford comprend que le noyau est lui-même composé de nucléons. Ces nucléons sont de deux sortes:
de charge positive, c'est un proton.
de charge neutre, c'est un neutron
Le neutron sera effectivement découvert en 1932 par Chadwick.
Le modèle planétaire de l'atome a un gros défaut. Les électrons peuvent émettre de la lumière sous certaines conditions (dans un ampoule électrique par exemple); ce faisant, ils perdent de l'énergie et devraient donc se rapprocher dangereusement du noyau jusqu'à s'y écraser!
Un tel atome ne serait donc pas stable.
L'ATOME DE BOHR
 
Afin de rendre compte de cette stabilité atomique, Niels Bohr crée en 1913 un nouveau modèle d'atome:
Les orbites des électrons ne sont pas quelconques mais "quantifiées"; seules certaines orbites particulières sont permises pour l'électron. Ce n'est que lorsque celui-ci saute d'une orbite à l'autre qu'il peut émettre (ou absorber) de la lumière.
VERS LA PHYSIQUE QUANTIQUE
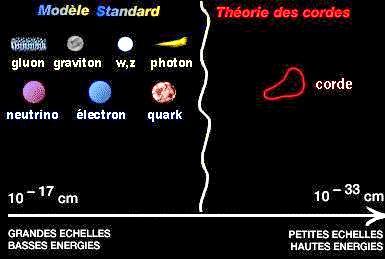
Le modèle de Bohr est le dernier modèle obéissant à la physique classique, c'est-à-dire la physique qui explique les mouvements et les phénomènes existant à notre échelle humaine. Ces modèles d'atomes sont donc faciles à comprendre et à se représenter.
Quel plaisir intellectuel (et quelle paresse!) que de se représenter les atomes sous forme de petites boules tournant les unes autour des autres...
Ce modèle est d'ailleurs toujours celui que le grand public affectionne!
Eh bien ce modèle est faux car à l'échelle atomique, de nouvelles lois s'appliquent! Ces lois appartiennent à une étrange physique très éloignée de nos concepts courant: la physique quantique.
Avant de continuer notre descente vers les constituants du noyau en découvrant ce qu'est la physique quantique et ses conséquences sur la représentation atomique, faisons le point sur ce que les physiciens savaient de l'atome dans les années 1930:

ATOMES dans l’UNIVERS
10 p80
Un nombre somme toute pas si grand!
Les atomes sont de petites particules qui s'assemblent pour former toute la matière
Un atome est la plus petite particule d'un élément chimique donné
Les atomes s'assemblent pour former des molécules, plus petit fragment indépendant d'une substance chimique
L'atome est constitué d'électrons gravitant autour d'un noyau, comme le feraient des satellites autour d'une planète
Représentation conventionnelle.
C'est un peu plus compliqué dès que l'on parle physique quantique: onde-particule

Le noyau est très petit par rapport à la taille de l'atome
La matière est essentiellement constituée de vide.
La masse est essentiellement concentrée dans la noyau
Un million d'atomes tiendraient dans l'épaisseur d'un cheveu
Il a 2 milliards d'atomes dans le point qui suit .
Si l'atome était un stade, le noyau serait une tête d'épingle au centre et les électrons seraient à la place des spectateurs, chacun ayant la taille d'un grain de poussière !!!
Modèle actuel de l'atome
Un noyau autour duquel existe
une zone sphérique centrée sur le noyau
et dans laquelle il y a une certaine probabilité de trouver les électrons (nuage électronique)
Du grec "a-tomos": "in-divisible"
TAILLE
10 -10
0,1 nanomètre
1 angström
Diamètre d'un atome moyen
Difficile à définir précisément, car pas de frontière précise
Il varie de 1 à 5 10p10 m
L'équation de Schrödinger permet de calculer la probabilité de présence d'un électron en fonction de la distance au noyau
10-10
Comparaison
10 -15
1 femtomètre
1 fermi
Diamètre du noyau (électron, neutron) : 100 000 fois plus petit
10-15
Atome complet: noyau avec son nuage électronique
Alignés, les atomes de l'Univers (10p80) s'étaleraient sur 10p70 m ou 10p54 années-lumières
Empaquetés, ils occuperaient un cube de 5 années-lumière de côté
1080 x 10-10 / 10p16
(3v(1080) x 10-10 / 10p16)
MASSE
200
0,1 nanomètre
1 angström
La masse de l'atome est concentrée dans son nucléon
La masse d'un atome varie grandement selon l'élément
Le plutonium est l'un des plus lourd
L'hydrogène est le moins lourd
Le ratio est de 200 en masse pour seulement 4 en diamètre
10-10
VITESSE
400
400 m / s
Vitesse des atomes à température ambiante
Ils se heurtent les uns aux autres dans un désordre indescriptible
400
NOMBRE de MASSE
12 C
6 C
Carbone à 12 nucléons
Carbone à Z = 6 protons
Carbone à N = 12-6 = 6 neutrons
Nombre de masse = quantité de nucléons (A)
= quantité de protons (Z) quantité de neutrons (N)
Normalement: quantité de protons = quantité de neutrons
Mais, un élément peut se présenter sous plusieurs masses atomiques: ses isotopes
Le nombre en haut à gauche témoigne de la masse atomique: nombre de masse
Numéro atomique = Z = quantité de protons
Normalement, c'est la moitié de la masse atomique
Sauf pour les isotopes, alors: masse atomique - numéro atomique = quantité de neutrons
Électrons (nombre de charge)
Neutre, l'atome a autant d'électrons que de protons
Nombre de charge = numéro atomique
S'il perd des électrons, c'est un ion positif (cation, il va vers la cathode)
S'il gagne des électrons, c'est un ion négatif (anion, il va vers l'anode)
Principe d'exclusion de Pauli
Carbone
Mnémotechnique: La cathode est l'électrode négative car MOKA (MOins CAthode)
Exemples
Nombre de masse
Nucléons
Numéro atomique
Protons
 
Neutrons
Électrons
A
Z
N
Carbone
12 6 C
12
6
6
6
Oxygène
16 8 O
16
8
8
8
Cuivre
63 34 Cu
63
34
29
34
Or
197 79 Au
197
79
118
79
 
ISOTOPES
Z identiques
N différents
Hydrogène
1 1 H
1
1
0
1
Deutérium
2 1 H
2
1
1
1
Tritium
3 1 H
3
1
2
1
ATOMES dans l’UNIVERS

Le nombre de noyaux d'atomes dans l'univers
est estimé à:
10 p78 < N < 10 p80

Si on les tassait, ils occuperaient une sphère de
1 milliard de km de diamètre :
6 fois la distance Terre Soleil
Calcul :
Rayon neutron : 1,2 10-15 m,
Moyenne de 10 neutrons / protons par noyau d'atome,
D = 10p78/3 x 1,2 10-15 x 10 => 109 km
Quelques exemples
Nombres d'atomes
dans ¯
10 p80
Univers
10 p57
Système solaire
10 p50
Planète Terre
2 10 p30
Statue de la Liberté
6,5 10 p27
Bébé de 7,5 kg
5 10 p25
1 m3 d'air
(pression atmosphérique normale)
4 10 p24
Souris
> 10 p24
Livre normal
10 p24
1g d'eau (de matière)
6 10 p23
2 g d'hydrogène (Avogadro)
3 10 p27
1 m3 d'air sur Terre
10p19
1 m3 d'air à 100 km d'altitude
10p10
1 m3 d'air à 1000 km d'altitude
< 10
1 m3 de vide intergalactique
(source Nasa)
la taple des elements periodique
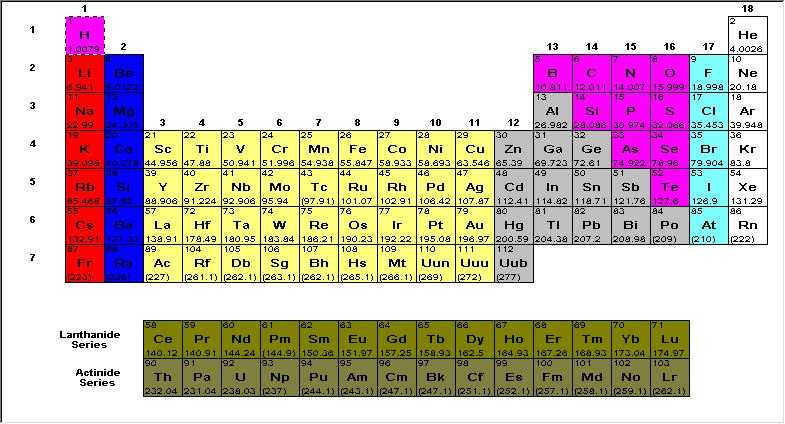
les nom des elements chimique
1H
Hydrogène 2He
Hélium
L 3Li
Lithium 4Be
Béryllium 5B
Bore 6C
Carbone 7N
Azote 8O
Oxygène 9F
Fluor 10Ne
Néon
M 11Na
Sodium 12Mg
Magnésium13Al
Aluminium 14Si
Silicium 15P
Phosphore 16S
Soufre 17Cl
Chlore 18Ar
Argon
N 19K
Potassium 20Ca
Calcium 21Sc
Scandium 22Ti
Titane 23V
Vanadium 24Cr
Chrome 25Mn
Manganèse 26Fe
Fer 27Co
Cobalt 28Ni
Nickel 29Cu
Cuivre 30Zn
Zinc 31Ga
Gallium 32Ge
Germanium 33As
Arsenic 34Se
Sélénium 35Br
Brome 36Kr
Krypton
O 37Rb
Rubidium 38Sr
Strontium 39Y
Yttrium 40Zr
Zirconium 41Nb
Niobium 42Mo
Molybdène 43Tc
Technétium 44Ru
Ruthénium 45Rh
Rhodium 46Pd
Palladium 47Ag
Argent 48Cd
Cadmium 49In
Indium 50Sn
Etain 51Sb
Antimoine 52Te
Tellure 53I
Iode 54Xe
Xénon
P 55Cs
Césium 56Ba
Baryum 71Lu
Lutécium 72Hf
Hafnium 73Ta
Tantale 74W
Tungstène 75Re
Rhénium 76Os
Osmium 77Ir
Iridium 78Pt
Platine 79Au
Or 80Hg
Mercure 81Tl
Thallium 82Pb
Plomb 83Bi
Bismuth 84Po
Polonium 85At
Astate 86Rn
Radon
Q 87Fr
Francium 88Ra
Radium
Lawrencium
L 57La
Lanthane 58Ce
Cérium 59Pr
Praséodyme 60Nd
Néodyme 61Pm
Prométhium 62Sm
Samarium 63Eu
Europium 64Gd
Gadolinum 65Tb
Terbium 66Dy
Dysprosium 67Ho
Holmium 68Er
Erbium 69Tm
Thulium 70Yb
Ytterbium
A 89Ac
Actinium 90Th
Thorium 91Pa
Protactinium 92U
Uranium 93Np
Neptunium 94Pu
Plutonium 95Am
Américium 96Cm
Curium 97Bk
Berkélium 98Cf
Californium 99Es
Einsteinium 100Fm
Fermium 101Md
Mendélévium 102No
Nobélium 103lr

|

|